ラーニングコーナー
2020/08/24
肺ALI培養および肺オルガノイドを用いた呼吸器疾患研究まとめ
- 用途別細胞培養
「オルガノイド研究ハンドブック」では、腸管・脳・膵臓・肝臓・腎臓・肺オルガノイドの培養プロトコル、アプリケーション、文献、FAQなどを紹介しています。
肺に関する基礎的・臨床的研究では、従来の2次元(2D)細胞培養モデルを用いてさまざまな研究がおこなわれてきました。しかし、2D培養モデルは生体内の環境とは大きく異なり組織的な違いがあります。そのため、臨床上で得られる観察結果と2D細胞培養モデルを用いたin vitroの結果を比較した場合、双方の相違を説明することができませんでした。
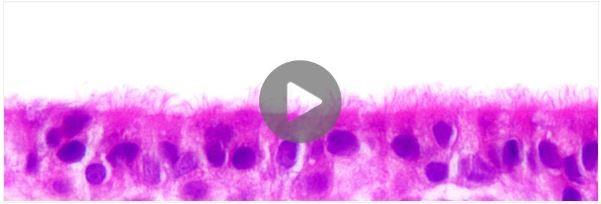
より適切に肺をモデル化するため、気道上皮の生理的環境をin vitroで再現する器官型培養系として開発されたのが「気液界面(Air-Liquid Interface, ALI)培養」です。PneumaCult™-ALI Mediumを用いてALI培養した気道上皮細胞は、広範囲に粘膜繊毛分化し、in vivoのヒト気道と同様の形態学的および機能的特徴を示す偽重層上皮を形成します。ALI培養は多くのアプリケーションに有用ですが、ハイスループット系での限界や、遠位気道に機能しないといった短所があります。
一方、気道上皮前駆細胞および間質細胞の分離ならびに肺の発達に重要なニッチ因子決定における最近の進歩は、in vitroの3次元(3D)肺培養系である「肺オルガノイド(pulmonary/lung organoid)」の確立を導きました。肺オルガノイドは、不均一な細胞組成、空間構成、自己再生能と分化能の両方を備えた幹細胞集団の保持といった肺のさまざまな特徴を再現します。肺オルガノイドは、ハイスループット系の受容性や遠位気道モデルに適するという点で、ALI培養を補完する可能性があります。
本稿では、PneumaCult™製品を用いた肺のALI培養および肺オルガノイド培養と、関連する呼吸器疾患の研究を紹介します。
肺ALI培養を用いた呼吸器疾患研究
プライマリーヒト気道細胞のALI(Air-Liquid Interface、気液界面)培養は、感染研究のin vitroモデルとして非常に適しています。これは、ALI培養がin vivoにおける気道の主要な特徴を正確に再現できるからです。たとえば、ALI培養は、気道細胞タイプの適切な比率、細胞の適切な極性と接合特性、粘液分泌や協調性線毛拍動などの動的生理学的プロセス、および特徴的なタンパク質の種固有の生理的発現と細胞内局在を示します。研究対象となるウイルスの感染メカニズムに応じて、これらの各プロパティはモデルシステムの決定的な特色となります。
ヒト気道のALI培養は、培養細胞の効率的な感染を可能にし、ウイルスの病原性と人間の病気のさまざまなメカニズムをモデル化するために使用されています(後述の文献例も参照)。このモデルは、特定のウイルス特性が感染中に病原性に対しどのように影響するかを研究するためのプラットフォームを研究者に提供します。たとえば、細胞内複製中のタンパク質相互作用、ウイルスの細胞侵入に影響する因子、感染の動力学の研究が含まれます。ALI感染モデルはまた、組織の損傷や細胞死のメカニズム、宿主の反応(感染に対するインターフェロン応答など)の探求にも使用されています。小児および成人の細胞から生成可能なALI培養の用途は、多岐にわたります。ALI培養はバクテリアとウイルスに同時感染し、人と家畜に共通する感染症ベクター(ブタなど)由来の培養物もヒト疾患動態の文脈で研究されています。ウイルス感染研究における有用性は抗ウイルス治療アプローチの開発ツールとしても表れており、モノクローナル抗体によるウイルス中和がこのモデルで評価されています。
ALI培養によるコロナウイルスの気道感染モデル
コロナウイルス(CoV)は、SARS-CoV-2ウイルスによって引き起こされるCOVID-19を含む、一般的な風邪から重度の呼吸器疾患までさまざまな病気を引き起こすウイルスの大きなファミリーです。SARS-CoV-2の細胞侵入受容体は最近、独立した研究グループによってアンジオテンシン変換酵素2(ACE2)であることが確認されています。これは、2003年にSARS流行を引き起こしたSARS-CoVの侵入受容体と同じです(文献1, 2)。
ALI培養で成長させたヒトの大・小気道培養物はACE2を豊富に発現しており(下図)、COVID-19に対する抗ウイルス介入のターゲットとしてACE2を研究するための生理学的関連性の高いモデルとなります。
COVID-19研究にALI培養が適する理由について、詳細は以下をご参照ください。
Studying COVID-19 with Air-Liquid Interface Cultures
PneumaCult™でALI培養したヒト気道上皮細胞(HBEC、HSAEC)におけるACE2の存在
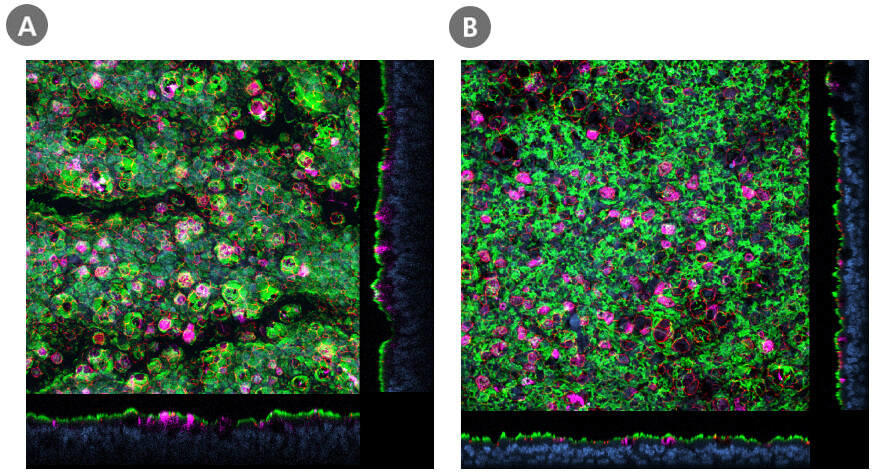
(A)PneumaCult-ALIで培養したヒト気管支上皮細胞(HBEC)、および(B)PneumaCult-ALI-Sで培養したヒト小気道上皮細胞(HSAEC)の、ALI培養のP2におけるホールマウント免疫染色共焦点画像です。ALI培養物を固定し、線毛細胞(AC-チューブリン; 緑)、SARS-CoV-2受容体(ACE2; マゼンタ)、および密着結合(ZO1; 赤)に対する抗体で染色しました。核はDAPI(青)で対比染色しました。ACE2は(A)大気道、(B)小気道ともに初期継代中(≤P6, HBEC; ≤P4, HSAEC)に検出されました。HBECとHSAECは、ALIで分化する前にPneumaCult-Ex Plusで増殖しました。
参考文献
ALI培養によるウィルス感染症研究
PneumaCult製品を用いたALI培養は、さまざまなウイルスの感染症研究で使用されています。以下に文献例をご紹介します。
パルボウイルス(Parvovirus; HBoV1)
- Wang K et al. (2020) Cellular cleavage and polyadenylation specificity factor 6 (CPSF6) mediates nuclear import of human bocavirus 1 NP1 protein and modulates viral capsid protein expression. J Virol 94(2): e01444–19
- Deng et al. (2017) Human parvovirus infection of human airway epithelia induces pyroptotic cell death by inhibiting apoptosis. J Virol 91(24):e01533–17.
RSウイルス(Respiratory syncytial virus; RSV)
- Wethington D et al. (2019) Mathematical modelling identifies the role of adaptive immunity as a key controller of respiratory syncytial virus in cotton rats. J R Soc Interface. 16(160):20190389.
- Anderson CS et al. (2019) CX3CR1 as a respiratory syncytial virus receptor in pediatric human lung. Pediatr Res doi: 10.1038/s41390-019-0677-0.
- Cortjens B et al. (2017) Broadly reactive anti-respiratory syncytial virus G antibodies from exposed individuals effectively inhibit infection of primary airway epithelial cells. J Virol 91(10): e02357–16.
インフルエンザ(Influenza)
- Richard M et al. (2020) Influenza A viruses are transmitted via the air from the nasal respiratory epithelium of ferrets. Nat Commun 7;11(1):766.
- Chen AJ et al. (2019) Anti-H7N9 avian influenza A virus activity of interferon in pseudostratified human airway epithelium cell cultures. J Virol 16(1):44.
- Meng F et al. (2019) Viral coinfection replaces effects of suilysin on Streptococcus suis adherence to and invasion of respiratory epithelial cells grown under air-liquid interface conditions. Infect Immun 87(8): e00350–19.
ライノウイルス(Rhinovirus)
- Wu Q et al. (2018) Overproduction of growth differentiation factor 15 promotes human rhinovirus infection and virus-induced inflammation in the lung. Am J Physiol Lung Cell Mol Physiol 314(3): L514–L527.
- Griggs TF et al. (2017) Rhinovirus C targets ciliated airway epithelial cells. Respir Res 18(1): 84.
- Warner SM et al. (2019) Rhinovirus replication and innate immunity in highly differentiated human airway epithelial cells.Respir Res 20(1):150.
ALI培養による呼吸器疾患モデル
ALI培養システムは、感染症に限らずさまざまな呼吸器疾患や創薬研究のための生理学的に適切なモデルを提供します。呼吸器疾患の患者由来プライマリーセルのALI培養によって、in vivoの疾患特徴を再現することが可能です。
- 喘息
- 慢性閉塞性肺疾患(COPD)
- 杯細胞過形成および過分泌
- 嚢胞性線維症(CF)
- 特発性肺線維症(IPF)
- 肺がん
肺オルガノイドを用いた呼吸器疾患研究
肺オルガノイドは肺幹細胞集団の増幅を可能にし、非常に限られた量のサンプルから分化細胞を誘導できます。また、特に遠位気道との生理学的関連性が高い培養系です。肺オルガノイドによる呼吸器疾患のモデル化は発展しており、肺がんや嚢胞性線維症の患者由来オルガノイドが樹立されています。
肺オルガノイドによるコロナウイルス感染の研究
気道オルガノイドのACE2(SARS-CoV-2受容体)発現
PneumaCult Apical-Out Airway Organoid Mediumで作製した頂端大気道オルガノイド(左)、および PneumaCult Alveolar Organoid Mediaで作製した肺胞オルガノイド(右)にはACE2が発現しています。
肺オルガノイドによる呼吸器疾患の研究
フォルスコリン誘発性膨張アッセイによる嚢胞性線維症(CF)の評価
PneumaCult™ Airway Organoid Kitで作製した、完全分化後の大気道オルガノイドをもちいてフォルスコリン誘発性膨張アッセイ(Forskolin-Induced Swelling Assay)をおこないました。(A)健康なドナーに由来するフォルスコリン処理オルガノイドは、DMSO処理コントロールと比較してサイズが増加し、機能的な嚢胞性線維症膜コンダクタンス制御因子(CFTR)タンパク質の発現を示しています。(B)フォルスコリン誘発性膨張は、CFドナーに由来するオルガノイドでは失われますが、VX-809処理により再確立されます。エラーバー:± 95% confidence interval for the mean (n=3)。(C)0時間および(D)6時間のアッセイ後に撮影された明視野画像では、処理後のオルガノイドの膨張を示しています。
肺の各領域に適したPneumaCult™製品選択
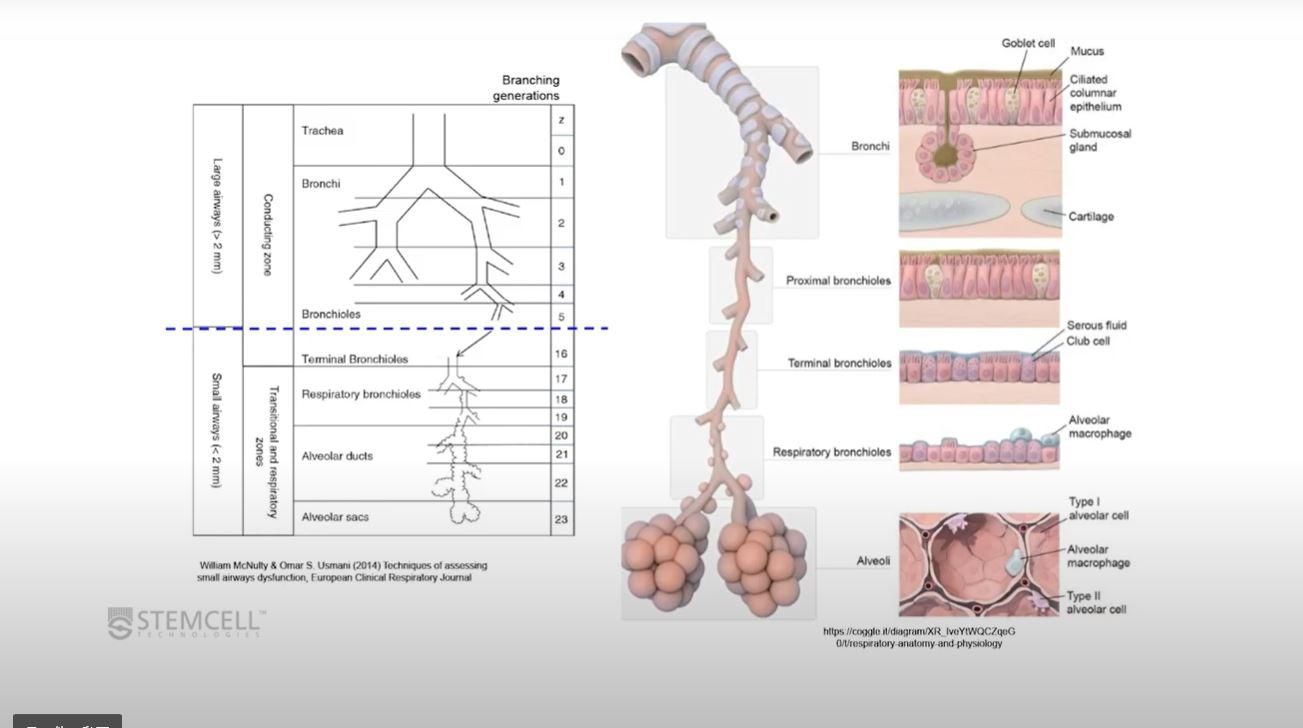
肺はガス交換に関与しない導管(気道)域と、ガス交換の場である呼吸域に分けられます。
肺の各領域の特徴
肺は鼻腔から肺胞嚢まで連続した上皮シートで覆われています。その形態と細胞組成、および関連する疾患は近位と遠位の領域で異なります。
近位の導管域には、鼻腔、気管、大気管支が含まれ、大気道とも呼ばれます。遠位の呼吸域には、呼吸細気管支や肺胞が含まれます。近位から遠位の中間にある移行域には、小気管支、細気管支が含まれ、小気道とも呼ばれます。
肺の各領域に適したPneumaCult™製品
肺の各領域をin vitroでモデル化するために、適切なPneumaCult™製品をご選択いただけます。いずれも、ヒトプライマリーセルから培養するための製品です。
ヒト多能性幹細胞から培養するためのSTEMdiff™製品については、ES/iPS細胞からさまざまな細胞への分化誘導 (STEMCELL Technologies社) をご参照ください。
大気道(導管域)に適した製品
- PneumaCult™-Ex(増殖)
- PneumaCult™-Ex Plus(より優れた増殖)
- PneumaCult™-ALI(2D分化)
- PneumaCult™ Airway Organoid Kit(3D分化)
- PneumaCult™ Apical-Out Airway Organoid Medium(頂端面を外側にした3D分化)
小気道(移行域)に適した製品
- PneumaCult™-Ex(増殖)
- PneumaCult™-Ex Plus(より優れた増殖)
- PneumaCult™-ALI-S(2D分化)
肺胞(呼吸域)に適した製品
- PneumaCult™ Alveolar Organoid Expansion Medium(3D増殖)
- PneumaCult™ Alveolar Organoid Differentiation Medium(3D分化)
PneumaCult™のワークフロー
in vitro 肺モデルのワークフロー
PneumaCult™の各製品をもちいて、初代ヒト気管支上皮細胞(HBEC)または気道上皮細胞(HAEC)から、気道ALI、気道オルガノイド、頂端気道オルガノイドの培養が可能です。また、初代ヒトⅡ型肺胞上皮細胞(ATⅡ)から、肺胞オルガノイドの培養が可能です。各培養系で使用する製品、および増殖~分化の流れを図に示しています。
動画・ウェビナーのご案内
動画:肺ALI培養のプロトコール
PneumaCult™を用いた気液界面(Air-Liquid Interface)でヒト気管支上皮細胞(HBEC)を増殖・分化する方法、および、ALI培養したHBECのバリア機能をTEERで評価する方法をご覧いただけます。
動画:PneumaCult-ALI 気管支上皮細胞のALI培養に最適化された培地
<演者> Dr. Michael Riedel(STEMCELL Technologies社)
<内容> PneumaCult-ALIの機能、利点、アプリケーションについて説明します。
ウェビナー:PneumaCult™-ALI: An Improved Medium Formulation for the Differentiation of Human Bronchial Epithelial Cells
<演者> Dr. Sam Wadsworth(James Hogg Research Centre at the University of British Columbia)
<内容> 生理学的関連性の高い気管支上皮培養は達成が難しい場合があります。PneumaCult™-ALI培地は、気液界面(ALI)で培養されたヒト気管支上皮細胞の粘液繊毛分化をサポートします。このウェビナーでは、ALI培養の特徴、およびアプリケーションの概要を解説します。また、PneumaCult™-ALIの性能に関するデータと、培養に用いることで達成できる優れた生理学的関連性についても論じます。
(視聴には、STEMCELL Technologies社ホームページへのログインが必要です)
ウェビナー:In Vitro Human Airway Modeling Using Primary Airway Epithelial Cells
<演者> Dr. Natalie Ronaghan(MITACS Postdoctoral Fellow at SickKids and STEMCELL Technologies)
<内容> 気液界面(ALI)培養と気道オルガノイド、2つのin vitro 気道モデルシステムの概要と、生理的な機能をもつ気道培養につながる主な要因を説明します。
(視聴には、STEMCELL Technologies社ホームページへのログインが必要です)
肺オルガノイドに関する情報
肺オルガノイドの動画、ウェビナー、インタビューをご覧いただけます。
関連情報
関連製品
-

PneumaCult ALI
-
PneumaCult-ALI Medium with 12 mm Transwell Inserts
-

PneumaCult-ALI Medium with 6.5 mm Transwell Inserts
-

PneumaCult-ALI-S Medium
-

PneumaCult-Ex Plus Medium
-

PneumaCult-Ex
-

PneumaCult Airway Organoid Kit
-

PneumaCult Apical-Out Airway Organoid Medium
-

PneumaCult Alveolar Organoid Differentiation Medium