ラーニングコーナー
2021/02/04
StemSpan™ Mediumを用いた白血病幹細胞・前駆細胞の培養
- 用途別細胞培養
本技術報告では、慢性骨髄性白血病(chronic myeloid leukemia; CML)または急性骨髄性白血病(acute myeloid leukemia; AML)の患者から分離した造血幹細胞および前駆細胞(hematopoietic stem and progenitor cell; HSPC)を、血清を含まないStemSpan™培地とサプリメントで培養する方法をご紹介します。
後述するプロトコルは、正常なHSPC向けに開発された分離・培養法を白血病HSPCに適するよう改変したものです。CMLとAMLの幹細胞・前駆細胞から分離したCD34陽性細胞をin vitro で効率的に増殖できます。培養開始時にサンプルの細胞数が少ない、または細胞の品質が良好でない場合にも有効です。
本稿は、STEMCELL Technologies社ウェブサイト(https://www.stemcell.com/culture-and-expansion-of-leukemic-cells.html)の内容を簡易訳したものです。
背景
白血病は、造血幹細胞・前駆細胞(hematopoietic stem and progenitor cell; HSPC)の悪性形質転換およびクローン増殖を特徴とする、血液や骨髄の疾患群です。
CMLは、9番および22番の染色体間の相互転座によりフィラデルフィア(Ph)染色体が生じることが原因で起こります(Figure 1)。融合遺伝子は恒常的な活性化チロシンキナーゼであるBCR-ABL腫瘍性タンパク質をコードしており、RAS/MAPK、 PI3K/AKT、JAK2/ STAT5など多くのシグナリング経路を撹乱することにより発病を引き起こします。これらのシグナリング経路の制御が乱れることで細胞増殖の亢進・アポトーシス減少が起こり、結果として循環血液中に骨髄細胞(大部分は顆粒球)が大量に集積します。
この特異的な単一の遺伝子変異が同定されたことで、CMLは他のタイプのがんにも通用するモデル疾患となり、これによりがんの進化研究やがん化細胞を標的とする分子治療法の開発が可能となりました。BCR-ABL腫瘍性タンパク質をターゲットとし白血病細胞の生存と増殖を抑制する、イマニチブやダサチニブなどの特異的なチロシンキナーゼ阻害剤が治療に導入されたことで、近年CML患者の生存率と予後は改善されました。
Figure 1. BCR-ABL融合遺伝子
BCR-ABLタンパク質をコードするフィラデルフィア(Ph)染色体の形成と生物学的影響についての略図。Lydon, 20096 より改変。
AMLは、CMLよりもはるかにヘテロな疾患です。染色体や遺伝子異常のタイプは様々であり、それらのリスクプロファイルや生存率、再発率も異なります (Table 1)¹。さらに、AML患者の細胞にはしばしば複数の遺伝子異常があり、それらは疾患の発病や進行に特有の影響を及ぼします。
Table 1. AMLにおける一般的な遺伝子異常
| 遺伝子異常 | リスクプロファイル | 5年生存率 | 再発率 |
|---|---|---|---|
| t(8;21)(q22;q22); RUNX1-RUNX1T1 | Favorable | 70% | 33% |
| t(8;21)(q22;q22); RUNX1-RUNX1T1 without mutated KIT | |||
| inv(16)(p13.1q22) or t(16;16) (p13.1;q22); CBFB-MYH11 | |||
| t(15;17)(q24;q21); PML-RARA | |||
| Mutated NPM1 without FLT3-ITD (normal karyotype) | |||
| Biallelic mutated CEBPA (normal karyotype) | |||
| t(8;21)(q22;q22); RUNX1-RUNX1T1 with mutated KIT | Intermediate | 48% | 50% |
| t(9;11)(p22;q23); MLLT3-KMT2A | |||
| Mutated NPM1 with FLT3-ITD (normal karyotype) | |||
| Wild-type NPM1 with FLT3-ITD (normal karyotype) | |||
| Other cytogenetic abnormalities not classified as favorable or adverse | |||
| inv(3)(q21q26.2) or t(3;3)(q21;q26.2); GATA2-MECOM | Adverse | 15% | 78% |
| t(6;9)(p23;q34); DEK-NUP214 | |||
| t(v;11)(v;q23); KMT2A rearranged | |||
| Mutated TP53 (regardless of abnormality) | |||
| Mutated DNMT3A (normal karyotype) | |||
| FLT3-ITD (normal karyotype) | |||
| KMT2A-PTD (normal karyotype) | |||
| –5 or del(5q); –7; abnl (17p); complex karyotype (3 or more chromosome abnormalities) |
CMLとAMLの研究はどちらも、正常のHSPCに用いるものに類似したin vitro の細胞培養系を利用することで飛躍的に発展してきました。In vitro 培養系はこれら疾患の基礎生物学的な解明に使用されてきましたが、患者由来のプライマリー細胞を用いれば、チロシンキナーゼインヒビターなどの化合物やその他の治療薬候補のスクリーニングにも利用できます²⁻⁴。しかしながら、プライマリーの白血病HSPCについての研究は、患者サンプル入手の困難さによってしばしば妨げられ、凍結保存細胞の解凍後の回収率と生存率の低さも問題を複雑にしがちです。
貴重な患者サンプルを培養する際には、信頼性が高く、成分が把握できており、対象の細胞種に最適な培地を選択することが重要です。本技術報告では、細胞培養に必要なStemSpan™ Serum-Free Expansion Medium II、StemSpan™ CD34+ Expansion Supplement、およびUM729 ⁵が付属したキット品である StemSpan™ Leukemic Cell Culture Kit を使用した実験系をご紹介します。
このほか、StemSpan™ SFEM、StemSpan™ CC100や StemSpan™ CC110 などの培地、サプリメント、および小分子も、同様の培養条件を作るのに使用できます。
白血病細胞培養のアプリケーション
• CMLやAMLの新しい治療法開発研究
• 疾患の進行と白血病幹細胞・前駆細胞のクローン進化に関する研究
• 現在の治療法に対する白血病幹細胞・前駆細胞の抵抗性、再発のメカニズムの解明
• 新規治療法に対する患者の反応を予測するアッセイ系の開発やバイオマーカーの同定
プロトコル
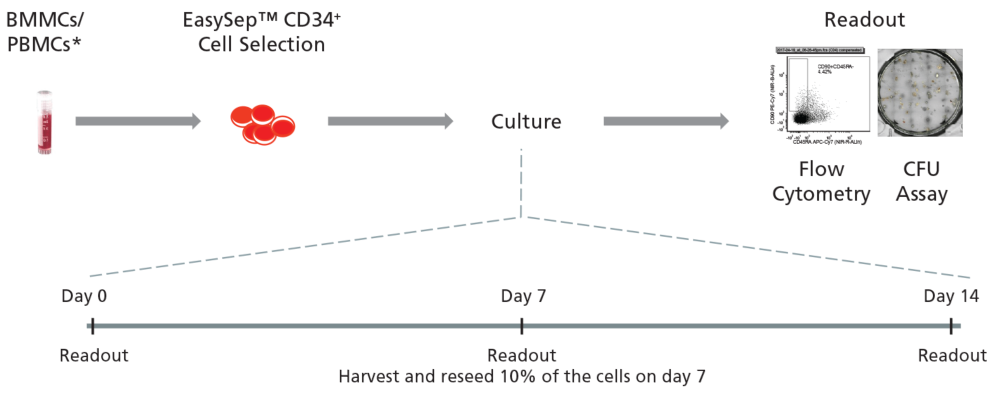
Figure 2. 白血病CD34陽性細胞の一般的な培養プロトコル概要
CMLまたはAMLのサンプルからEasySep™ Human Cord Blood CD34 Positive Selection Kit II でCD34陽性細胞を精製し、UM729 の存在下または非存在下にてStemSpan™ CD34+ Expansion Supplement を添加したStemSpan™ SFEM II 中で14日間培養します。細胞は培養0、7、14日後にMethoCult™ H4435 Enriched medium を使用したコロニー形成ユニット(CFU)アッセイや、HSPCの細胞表面に発現する一般的なマーカー分子のイムノフェノタイピングで解析します。
ご注意: 本技術報告では、凍結保存細胞を用いて実験していますが、新鮮サンプルでも同様の結果が期待できます。また、Figure 4~7では、小分子としてUM729の代わりにUM171が使用されています。UM171はSTEMCELL Technologies社では現在販売していませんが、代わりにUM729を終濃度1 μM で使用すると同様の結果が期待できます(データ非掲載)。特定の条件で細胞増殖を最適化したい場合には、さらに濃度を検討する必要があります。UM171とUM729の比較データを含む詳細な情報は、文献(Fares et al. 2014)を参照してください。
分離
- 新鮮な末梢血単核球(peripheral blood mononuclear cell; PBMC)または骨髄単核球(bone marrow mononuclear cell; BMMC)を使用する場合は、ステップ2から直接始めてください。
凍結PBMCまたはBMMCを使用する場合は、サンプルの入った1 mLバイアルを37℃のウォーターバスで解凍してください。解凍後はすぐに、0.5 mLのDNase I Solutionを添加して穏やかに混合し、室温(15 - 25°C)で5分間インキュベートします。細胞の回収量と生存率が低下する恐れがあるため、CD34陽性細胞の分離前にサンプルを洗浄することは推奨されません。この方法で細胞を解凍すると、白血病CD34陽性細胞の回収量を増やし、生存率を向上させることができます。 - EasySep™ Human Cord Blood CD34 Positive Selection Kit IIを使用し、(DNase I処理した解凍PBMC/BMMC、または新鮮PBMCから)CD34陽性細胞を分離します。このキットは臍帯血向けの製品ですが、CMLやAMLサンプルに対する性能も十分に検証済みです。
- トリパンブルーと血球計算盤、または自動セルカウンターを使用して生細胞の細胞数とパーセンテージを求めます。十分な細胞数が得られている場合には、CD34陽性細胞のパーセンテージはフローサイトメトリーでも測定できます。サンプル中のCD34陽性細胞の細胞数や濃度は、全生細胞数にCD34陽性細胞のパーセンテージをかけて算出できます。
培養
- 次の試薬を混合し、100 mLの白血病細胞培養用培地を調製します:
• 90 mL StemSpan™ SFEM II
• 10 mL StemSpan™ CD34+ Expansion Supplement
• UM729 (終濃度1μM *) - CD34陽性細胞(生細胞)を次のいずれかの要領で播種します:
• 96ウェルプレートの1ウェルあたり、細胞1000個を100μLの白血病細胞培養用培地に懸濁して播種
または、
• 12ウェルプレートの1ウェルあたり、細胞1000-10000個を1 mLの白血病細胞培養用培地に懸濁して播種 - 37°C で7日間インキュベートします。**
- 7日目に細胞を回収して洗浄し、1 mLのIscove’s MDM (サイトカイン、サプリメント非添加)に懸濁します。
- 細胞懸濁液の10%分を、新鮮な白血病細胞培養用培地(ステップ 4で調製)に懸濁して再度播種し、37℃でさらに7日間インキュベートします。
- 14日目に細胞を回収して洗浄し、ステップ7と同様に再懸濁します。
* UM171を使用する場合、終濃度 175 nMに調製してください。
** 細胞培養期間の長さは、実験の目的や必要性に応じて調整できます。7日より長期に培養する場合、7日目にステップ7と8をおこない、その後も7日ごとに同様の操作をおこなうことを推奨します。解析
- a. フローサイトメトリー解析により、0日目(CD34陽性細胞分離後に十分な細胞数が得られた場合)、培養後の7日目および14日目に、HSPCマーカー分子(CD45, CD34, CD45RA, CD90)を発現する細胞数と表現型を決定します。
HSPCマーカー染色と並行して、初期の幹細胞および前駆細胞で高いアルデヒドデヒドロゲナーゼ(aldehyde dehydrogenese; ALDH)の活性も、ALDEFLUOR™を用いて決定できます。
b. MethoCult™ H4435 Enriched mediumを使用したコロニーアッセイで、0日目、培養後の7日目および14日目の造血前駆細胞の発生頻度と総細胞数を計測します(詳細は、StemSpan™ Leukemic Cell Culture Kitの製品情報シートを参照)。14日間の培養後に、コロニー数をカウントしてください。
オプション: CMLサンプルの場合、コロニーを14日目に回収して解析(BCR-ABLステータス決定のためのcDNA調製とqPCRなど)に使用できます。プライマーの情報はTable 2を参照してください。AMLサンプルの場合、シーケンシングやqPCRを行って融合遺伝子やその他の遺伝子変異の有無を確認できます。
結果
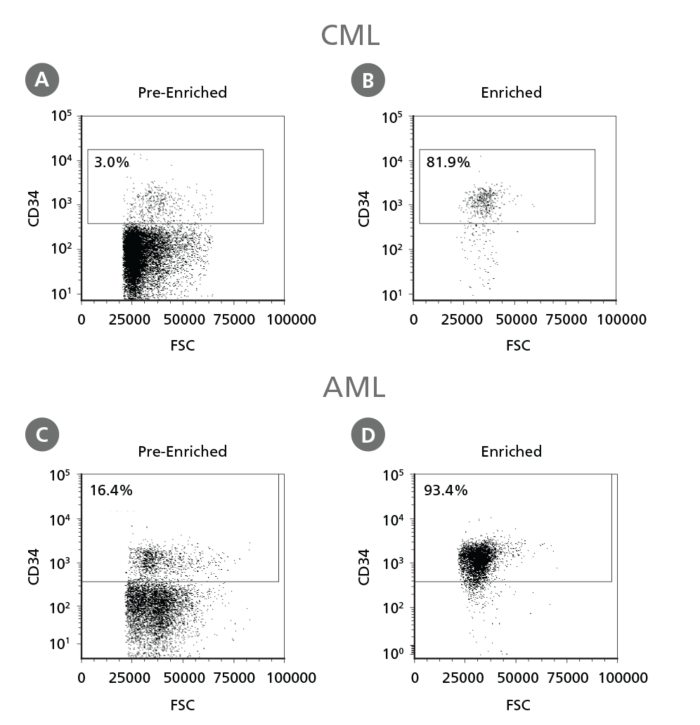
Figure 3. 白血病CD34陽性細胞の分離
凍結保存されたCMLやAMLのPBMC、BMMCは解凍し、プロトコルのステップ1に従って処理しました。CD34陽性細胞はEasySep™ Human Cord Blood CD34 Positive Selection Kit IIで分離しました。CD34陽性細胞のパーセンテージはCD34陽性細胞の細胞分離前(A, C)と後(B, D)にフローサイトメトリーで測定しました。死細胞は光散乱プロファイルと生死判定細胞染色によって排除しました。この例ではCD34陽性細胞の純度がCMLで3%から82%、AMLで16%から93%に増加しました。
Figure 4. CD34陽性CML細胞の増殖
CD34陽性CML細胞はプロトコルに従い、CD34⁺ Expansion Supplement (Exp)を添加したStemSpan™ SFEM II を使用してUM171(UM)の存在下、または非存在下で培養しました。細胞は培養7日後と14日後にCD45、CD34、CD90、CD45RAの各蛍光標識抗体、ならびにALDH活性を測定するALDEFLUOR™で染色し、フローサイトメトリーで解析しました。一連のゲートはCD45+、CD45+CD34+、CD45+CD34+、CD45+CD34+CD90+CD45RA-の生細胞(各細胞集団のゲートはFluorescence Minus One (FMO)コントロールとの比較により決定)とALDHbr細胞(DEABコントロールとの比較により決定)のパーセンテージを求めるために設定しました。(A)7日目の代表的なフローサイトメトリープロファイル。インプットしたCD34陽性細胞1個から生じる各ゲートの細胞サブセットの発生頻度(B, D)とそれらの細胞数(C, E)。(B、C)は7日目、(D、E)は14日目に得られたデータです。
CD34⁺ Expansion Supplement (Exp)を添加したStemSpan™ SFEM IIはCML細胞培養時に増殖をサポートします。UM171の添加により、全てのサブセットの増殖が亢進します。(CD34陽性の前駆細胞はUM171無しの場合と比較して、7日目で〜10倍、14日目で〜20倍に増加しました。)UM729を終濃度1μMで使用した場合にも同様の結果が期待できます。データは平均値± SEMで示しました(n=6)。P値は両側検定のStudentのt検定を用いて算出しました(*P < 0.05; **P < 0.01; ***P < 0.0001)。6つのCMLサンプル全てが培養で増殖しました。
Figure 5. CD34陽性AML細胞の増殖
CD34陽性AML細胞はプロトコルに従い、CD34⁺ Expansion Supplement (Exp)を添加したStemSpan™ SFEM IIを使用して、UM171(UM)の存在下、または非存在下で培養しました。培養7日後と14日後、Figure 4と同様に細胞を蛍光標識抗体とALDEFLUOR™で染色しました。(A) 7日目の代表的なフローサイトメトリープロファイル。インプットしたCD34陽性細胞1個から生じる各ゲートの細胞サブセットの発生頻度(B, D)と細胞数(C, E)。(B、C)は7日目、(D、E)は14日目に得られたデータです。CD34⁺ Expansion Supplement (Exp)を添加したStemSpan™ SFEM IIはAML細胞培養時に増殖をサポートします。UM171の添加により、全てのサブセットの増殖が亢進します。(CD34陽性の前駆細胞はUM171無しの場合と比較して、7日目で〜3倍、14日目で〜7倍に増加しました。)UM729を終濃度1μMで使用した場合にも同様の結果が期待できます。データは平均値± SEMで示しました(n=6)。P値は両側検定のStudentのt検定を用いて算出しました(*P < 0.05; **P < 0.01)。10個中6個のAMLサンプルが培養で増殖しました。
UM171の存在下では、AML培養の7日目と14日目のCD34+細胞、
CD34+CD90+CD45RA-細胞、ALDHbr細胞の発生頻度(Figure 5)は、CMLサンプル(Figure 4)と類似していました(CML、AMLとも7日目でCD34陽性細胞が〜80%)。一方、CD34+細胞、CD34+CD90+CD45RA-細胞、ALDHbr細胞の細胞数はそれぞれ、AMLサンプル(Figure 5)はCMLサンプル(Figure 4)より2.5倍少なくなっていました(7日目のCD34陽性細胞の増殖は、CMLサンプルで〜70倍なのに対しAMLで〜30倍)。
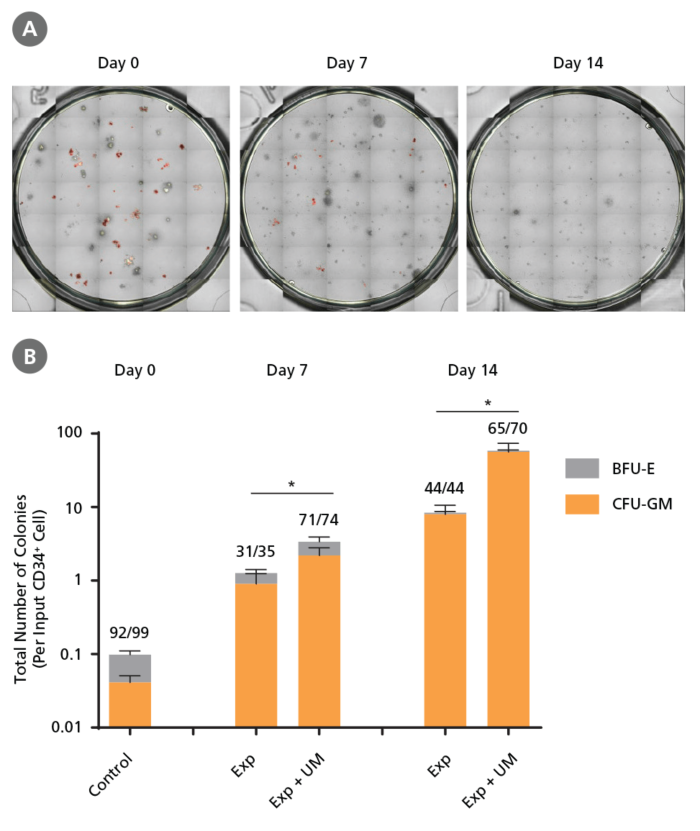
Figure 6. 培養中のCD34陽性CML細胞で維持されるコロニー形成能
CML細胞は、CD34陽性細胞分離直後(0日目)、またはCD34⁺ Expansion Supplement (Exp)を添加したStemSpan™ SFEM II を用いてUM171(UM)の存在下または非存在下で増殖後7日目、14日目に(Figure 4参照)、MethoCult™ H4435 Enriched medium に播種してコロニーアッセイをおこないました。(A)STEMvision™で取得したコロニー画像。コロニー数はこのデジタル画像を基に手動でカウントしました。(B) インプットしたCD34陽性細胞1個から生じるコロニー総数を表すCFUアウトプット。各棒グラフ上の数値はBCR-ABL陽性コロニーの全コロニーに対する存在比率で、6つの異なるサンプルから個別に採取したコロニーのqRT-PCRの結果に基づいています(各実験条件のサンプルあたり8-12個のコロニーを採取して使用。プライマーと作業工程の詳細についてはTable 2、Figure 8参照)。CD34⁺ Expansion Supplement (Exp)を添加したStemSpan™ SFEM IIは、コロニー形成前駆細胞の増殖をサポートします。UM171はさらにコロニー形成能を亢進させます(7日目で〜3.5倍、14日目で〜8倍の増殖)。UM729を終濃度1 μMで添加した場合も、同様の結果が期待できます。単一のコロニーに対するqRT-PCRにより、0日目、増殖後の7日目、14日目のサンプルから得られたコロニーでは大部分がBCR-ABL陽性でありながら、BCR-ABL陰性の正常な前駆細胞も低頻度で存在することが明らかになりました。データは平均値± SEMで示しました(n=6)。P値は両側検定のStudent's t検定で算出しました(*P < 0.05)。
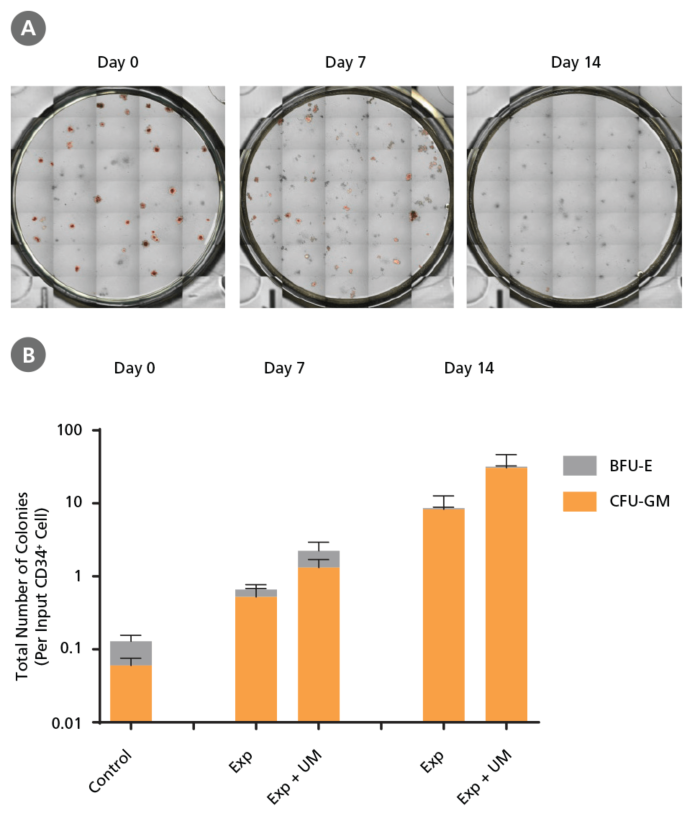
Figure 7. 培養中のCD34陽性AML細胞で維持されるコロニー形成能
AML細胞は、CD34陽性細胞分離直後(0日目)、またはCD34⁺ Expansion Supplement (Exp)を添加したStemSpan™ SFEM II を用いてUM171(UM)の存在下または非存在下で増殖後7日目、14日目(Figure 5参照)に、MethoCult™ H4435 Enriched mediumに播種してコロニーアッセイをおこないました。14日間の培養後に次のデータを得ました。
(A)STEMvision™で取得したコロニー画像。コロニー数はこのデジタル画像を基に手動でカウントしました。 (B) インプットしたCD34陽性細胞1個から生じるコロニーの総数を表すCFUアウトプット。CD34⁺ Expansion Supplement (Exp)を添加したStemSpan™ SFEM IIは、コロニー形成中の前駆細胞の増殖をサポートします。UM171はさらにコロニー形成能を亢進します(7日目で〜3倍、14日目で〜4倍の増殖)。UM729を終濃度1 μMで添加した場合も、同様の結果が期待できます。データは平均値± SEMで示しました(n=6)。P値は両側検定のStudent's t検定で算出しました(*P < 0.05)。
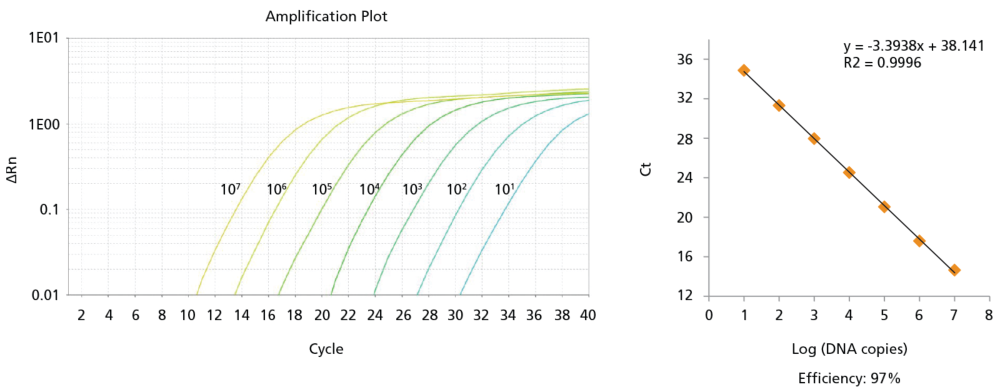
Figure 8. プローブを使用したqPCRアッセイで、CD34陽性CML細胞のCFUアッセイで生じた1個のBCR-ABL陽性コロニーを検出
プローブベースのqPCRアッセイにより、Figure 6と同様、増殖前および7または14日間の増殖後のCML細胞から生じる単一のBCR-ABL陽性コロニーを同定しました。プライマーセットは全て90%を超えるプライマー効率で、わずか10個のDNAコピーを検出可能です。b2a2 合成DNAフラグメントに対してBCR-ABLの汎用プライマーを用いた場合の増幅曲線 (Amplification plot)と標準曲線。各曲線グラフ横の数字はDNAコピー数を表します。プライマーとプローブの配列、終濃度、プライマー効率はTable 2を参照。
Table 2. 使用したプライマーとプローブの配列、終濃度、プライマー効率
| 標的 | プライマー | 5’- | 終濃度 (1X) |
プライマー効率 対 合成DNA; R2値 |
|---|---|---|---|---|
| FW | TCCGCTGACCATCAAYAAGGA | 300 nM | ||
| BCR-ABL (generic) |
REV | CACTCAGACCCTGAGGCTCAA | 300 nM | 97%; 0.9996 |
| Probe | CCCTTCAGCGGCCAGTAGCATCTGA | 200 nM | ||
| FW | GGGCTCTATGGGTTTCTGAATG | 400 nM | ||
| BCR-ABL (b3a2 specific) |
REV | CGCTGAAGGGCTTTTGAACT | 400 nM | 99%; 0.9995 |
| Probe | CATCGTCCACTCAGCCACTGGATTTAAGC | 200 nM | ||
| FW | ATCCGTGGAGCTGCAGATG | 400 nM | ||
| BCR-ABL (b2a2 specific) |
REV | CGCTGAAGGGCTTCTTCCTT | 400 nM | 100%; 0.9996 |
| Probe | CCAACTCGTGTGTGAAACTCCAGACTGTCC | 200 nM | ||
| FW | CCTTCGACGTCAATAACAAGGAT | 500 nM | ||
| BCR | REV | CCTGCGATGGCGTTCAC | 500 nM | 99%; 0.9999 |
| Probe | TCCATCTCGCTCATCATCACCGAC | 250 nM |
参考文献
- Döhner H et al. (2015) N Engl J Med 373(12): 1136–52.
- Pabst C et al. (2014) Nat Methods 11(4): 436–42.
- Liao Z et al. (2015) Mol Cancer Ther 14(8): 1777–93.
- Baccelli I et al. (2017) Blood Cancer J 7(2): e529.
- Fares I et al. (2014) Science 345(6203): 1509–12.
- Lydon N. (2009) Nat Med 15(10): 1153–7.