ラーニングコーナー
2019/07/22
ES/iPS細胞培養におけるシングルセル継代の課題
- 用途別細胞培養
ヒト胚性幹細胞(hESC)およびヒト人工多能性幹細胞(hiPSC)を含むヒト多能性幹細胞(ES/iPS細胞、hPSC)は、自己複製能と様々な細胞に分化する能力(多分化能)を持つため、臨床、創薬、および再生医療への応用において非常に大きな可能性を秘めています。従来のヒト多能性幹細胞培養法は、マウスまたはヒトの線維芽細胞のようなフィーダー細胞層の上で培養するものでした。
一方、近年よく利用されているフィーダーフリー培養では、フィーダー細胞を使わず、代わりに細胞外マトリックス(例:Corning Matrigel®)、または最近ではさまざまな組み換えタンパク質(例:Laminin, Vitronectin)、および合成基質のいずれかが利用されています。フィーダー細胞の有無やマトリックスの違いの他に、継代方法としてシングルセル継代、クランプ継代の違いもあります。
本稿では、シングルセル継代の課題に関する情報をまとめました。
動画のご紹介
ヒト多能性幹細胞(hPSC)の生物学の概要、hPSCの品質と特性を評価する方法、プレートコーティング、培地の選択肢、継代から凍結保存までhPSC培養を維持する方法を動画で紹介
Complete a Virtual Training Course on Pluripotent Stem Cell Quality and Maintenance
(動画の視聴にはSTEMCELL Technologies社ウェブサイトにて登録が必要です)
ES/iPS細胞のシングルセル継代における課題とは?
シングルセル継代の課題
hPSC培養におけるシングルセル継代には、細胞品質に深くかかわる以下のような課題があります。それぞれの詳細については以降の項で説明します。
- 核型異常を引き起こしたクランプをシングルセル化して継代することで、その後のすべての培養に核型異常細胞がコンタミするリスクが高い
- シングルセル剥離試薬(Trypsin、TryPLEおよびAccutase)による核型異常の増加
- シングルセル化による剥離、及びその後の低密度での再プレーティングは、細胞損傷や細胞死(アポトーシス)を引き起こす
- クランプ(クラスター)継代では可能な細胞形態(Morphology)による品質評価が難しい
ES/iPS細胞培養の継代と核型異常
クランプ継代 vs. シングルセル継代
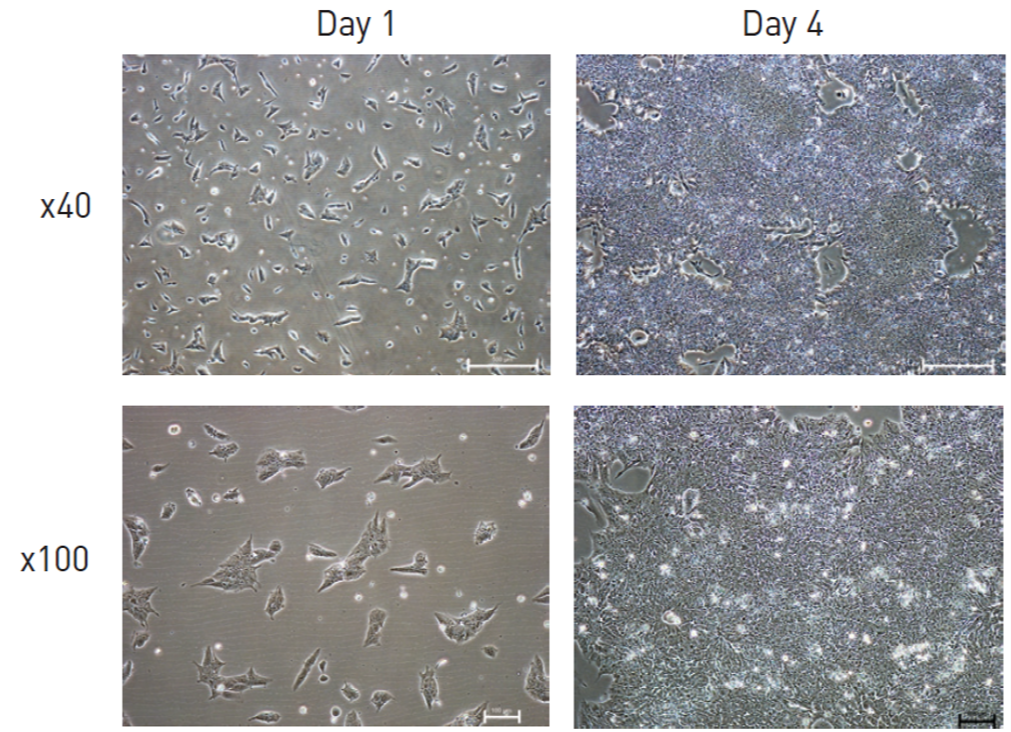
ES/iPS細胞培養で行われる継代法には、継代操作の違いにより二つの方法「クランプ継代」と「シングルセル継代」があります。クランプ継代では、ES/iPS細胞のコロニーを小さい細胞塊に断片化し播種することにより、通常コロニーとして培養されます(図1-(A))。シングルセル継代では、完全に解離してシングルセル化したES/iPS細胞懸濁液を播種することにより、単層培養します(図1-(B))。
単層培養でのシングルセル継代法は、より増殖が速く、多くの細胞が得られる利点を有すると言われます。しかし、ES/iPS細胞のシングルセル剥離操作は、長期培養時にES/iPS細胞にゲノム変異を引き起こすことが示されています(Bai Q, et al.,2015; Garitaonandia I, et al. 2015)。
図1-(A) クランプ継代の細胞形態
図1-(B) シングルセル継代の細胞形態
シングルセル継代は核型異常細胞を継代しやすい
ES/iPS細胞はクラスター継代でもシングルセル継代でも核型異常を引き起こしますが、問題はその核型異常を引き起こした細胞がどのように継代されるかにある、と考えられています。
シングルセル継代では、図2-(B) のように核型異常を引き起こしたクランプがシングルセル化されて継代されるため、ほとんどすべての培養系にコンタミ(継代)されます。その培養方法からわかるように、核型異常を引き起こした細胞が継代の際に容易に(除去される事なく)継代され、数回の継代でそれらがdominantな細胞になります。
図2-(A) クランプ継代の模式図
図2-(B) シングルセル継代の模式図
赤:遺伝子変異を起こしたクランプまたは細胞、〇:クランプ、 ・:シングルセル
シングルセル継代による核型異常の増加
シングルセル継代は遺伝的異常の獲得速度が速い
継代の際に、ES/iPS細胞を細胞塊もしくはシングルセルとして解離させるために、各種の剥離酵素、セルスクレーパー、その他の継代ツールなど、様々なアプローチが開発されてきました。
Geritaonandiaらの研究では、ヒトES/iPS細胞のシングルセル継代(Accutaseでの酵素的剥離)では、クランプ継代(物理的・機械的剥離)と比べて、より高い頻度の遺伝子重複(complex CNVs)や欠失(regions of loss of homozygosity (LOH))が観察される事がわかりました。
図3 クラスター継代よりシングルセル継代の方が、明らかに早い段階で核型異常を獲得し、その数も多い
(紫)MefMech:クランプ継代;(赤)EcmMech:クランプ継代;(緑)MefEnz:シングルセル継代;(青)EcmEnz シングルセル継代(Garitaonandia I, et al. 2015よりFigureの抜粋)。
ヒトES/iPS細胞をシングルセル継代することは可能ですが、細胞集団に望ましくない選択圧をかける可能性があり、遺伝的異常をもたらす可能性があると言われています(Draper JS et al. 2004, Andrews PW et al. 2006, Bai Q et al. 2015)。したがって、シングルセル継代を行う場合は、核型を頻繁にチェックして、細胞が正常な核型を保持していることを確認する事が重要になってきます。
Baiらの研究では、酵素的剥離によるシングルセル継代は、限られた期間だけ使用された場合でも、ES/iPS細胞のゲノムにとって非常に有害であり得ることを示しています。
図4 酵素で剥離したシングルセルの継代培養におけるゲノム異常獲得は速い
(A)酵素的剥離による継代(Enzymatic passage)、または物理的・機械的剥離による継代(Mechanic passage)における、ヒトES細胞(hESC)のゲノムコピー数変異(CNV)の推移。各継代数で培養された3つのhESC株における、CNVを有するセグメントの総数(上のパネル)、および長さ(下のパネル)を示す。(Bai Q, et al.,2015よりFigureの抜粋)
分化またはトランスフェクションの実験では、TryPLEおよびAccutaseをもちいてES/iPS細胞をシングルセル化する事が殆どですが、その生存率が低いと核型が異常になることがよくあると報告されています(Beers J. et al. 2012)。
また、トリプシン(Trypsin)を用いてヒトES細胞をシングルセルに解離させると、最初の5〜10継代の間にプレーティング効率が劇的に低下し(<3%)、30継代後に出現する新たな亜系統が、検出可能な核型異常を通常に獲得する事も報告されています(Hasegawa et al., 2006)。
シングルセル化が細胞に与えるダメージ
シングルセル剥離による細胞の損傷
ES/iPS細胞をシングルセルに剥離し低密度で再プレーティングすると、細胞損傷および細胞死(アポトーシス)が引き起こされるという報告(Amit, M. et al. 2000; Mitalipova, M. M. et al. 2005; Watanabe, K. et al. 2007; Ohgushi, M. et al. 2010; Beers, J. et al. 2012)があります。
ES/iPS細胞継代をシングルセルに剥離させて行うと、酵素が細胞表面タンパク質を消化することによって細胞損傷を誘発する可能性もあります(Mitalipova, M. M. et al. 2005; Beers, J. et al. 2012)。
細胞の一様な分布および均一な処理を達成するためのシングルセル培養法は、継代する時に細胞のシングルセル化が必要ですが、hPSC(ES/iPS細胞)の場合にはシングルセル化すると生存率が低下すると言われています。これらの細胞がシングルセル化処理に対してより敏感で、細胞死を起こしやすいのが原因です(Beers J. et al. 2012)。Chen G.らのグループは、シングルセル化した細胞死のメカニズムを研究し、ミオシン-アクチン(myosin-actin)依存性収縮が細胞死をもたらすこと、収縮を阻害することによって細胞-細胞接着が細胞生存率を促進することを発見しました。また結果として、シングルセル継代では細胞密度が生存率に影響する事を明らかにしました(図5)。
図5 シングルセル解離後の密度依存的細胞生存率の経時変化
異なる数のヒトES細胞を各ウェルに播種した:3,000/cm2(3K‐青色の菱形)、10,000/cm2 (10K‐赤色の正方形)、30,000/cm2 (30K‐緑色の三角形)。「Survival Index(生存指数)」は、生存細胞数を播種細胞数で割ったもの(細胞が分裂するにつれて最終的に100%を超える可能性がある)。Chen G et al., 2010
単層培養では細胞形態に基づく品質評価が困難
シングルセル継代では形態による細胞品質評価が難しい
細胞形態(morphology)は細胞品質の敏感な指標であり、形態にもとづく細胞品質の評価、モニタリングも重要と言われています。シングルセル継代で単層培養された細胞の形態からは細胞品質の評価が困難ですが、クランプ継代ではコロニーの状態で培養された細胞の形態(コロニーの形、S/Nなど)にもとづく細胞品質評価が容易になります(図6, 7)。主な評価基準を以下に示します。
クランプ継代における、ES/iPS細胞の望ましい形態
- 丸く、packされた状態
- 核質の割合(S/N)が多い
- コロニーのエッジがスムーズな状態
- コロニーの中心部はマルチレイヤーになっており、顕微鏡下ではBrightな状態
(STEMCELL Technologies社による基準です)
図6 クランプ継代とシングルセル継代で培養されたiPS細胞の形態
(左)クランプ継代の望ましい形態、(中)クランプ継代の望ましくない形態、(右)シングルセル継代での細胞形態
図7 クランプ継代での細胞形態スコアリング(Morphology Scoring)
最適な培地条件(黄色)、最適でない培地条件(黒色)
※STEMCELL Technologies社の基準でのスコアリング







